 2024/10/11
2024/10/11科研课题(研究者发起的临床研究、立项后纵向课题等)初始审查申请
一、申请流程
(一)药物临床试验机构办公室申请立项;
(二)联系伦理办020-87609616,本院研究者在OA伦理办形式审查流程申请。
二、递交资料清单
| 内容 |
1 | 初始审查申请书 |
2 | 临床研究方案(注明版本号及版本日期) |
3 | 知情同意书(注明版本号及版本日期) |
4 | 伦理委员会投票表 |
5 | 申办方是外单位或公司(厂家)需附初步合作协议 |
6 | 研究病历(如有)(注明版本号及版本日期) |
7 | 病例报告表(如有)(注明版本号及版本日期) |
8 | 研究者手册(如有)(注明版本号及版本日期) |
9 | 用于招募受试者的布告、广告等材料(如有)(注明版本号及版本日期) |
10 | 受试者日记卡和其他问卷表(如有)(注明版本号及版本日期) |
11 | 产品(药物)说明书、质检报告(如有) |
12 | 有公司合作的,另外附公司资质证明、药品生产许可证等; |
13 | 涉及设备(仪器)需提供厂家资质证明、合格证等相关材料; |
14 | 研究参加人员签名列表,包括姓名、职称、任务分工、GCP培训有无 |
15 | 主要研究者专业履历,包括:个人简历、执业证书、资格证书复印件、GCP培训证书复印件。 |
16 | 多中心研究需提供牵头单位伦理委员会的全部伦理审查意见 |
17 | 研究者发起的涉及人的生命科学和医学研究项目信息表 |
18 | 外送样本处理承诺函(如需外送样本) |
19 | 生物样本获取申请表(如需使用人体生物样本,含检验、手术、活检剩余样本) |
20 | 项目负责人承诺书 |
21 | 其他 |
相关模板在以下OA流程中可下载使用。
三、OA伦理流程操作方法
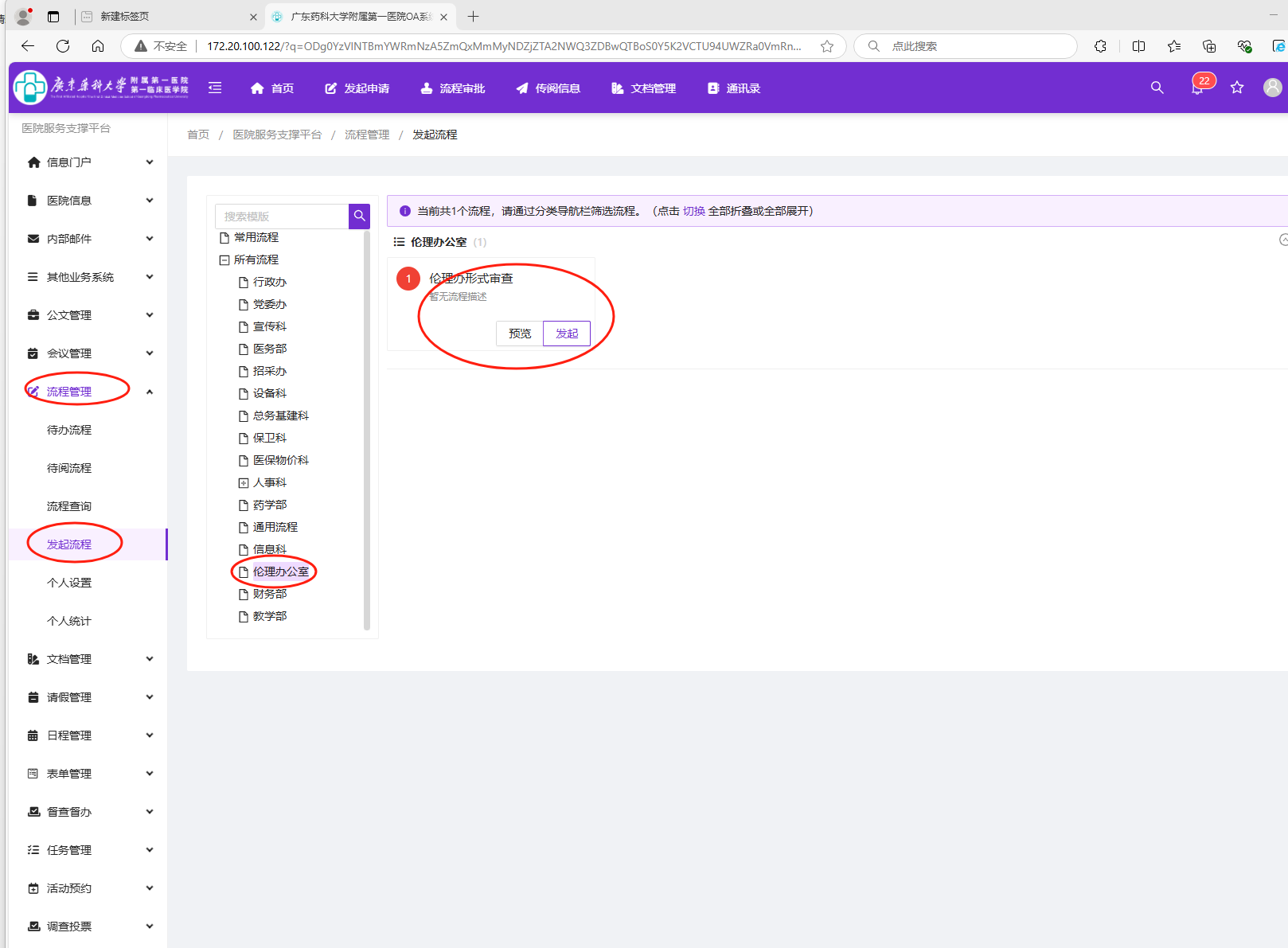
四、伦理形式审查通过后将在系统告知递交纸质资料进行线下审查。
五、附件
科研课题初审下载//www.630770.com/upload/file/20241011/20241011085624612461.zip